“ADC(抗体药物偶联物)第一股”又官宣一笔BD(商务拓展),标的却是一款眼科创新药。
8月19日早间,荣昌生物(688331.SH,股价80.8元,市值455.40亿元)公告,公司与日本参天制药株式会社(以下简称参天制药)全资子公司参天制药(中国)有限公司(以下简称参天中国)签署授权许可协议,双方就眼科创新药RC28-E达成大中华区及韩国、泰国、越南、新加坡、菲律宾、印度尼西亚及马来西亚的独家授权合作。
根据协议,荣昌生物将取得2.5亿元首付款,还包括最高可达5.2亿元的开发及监管里程碑付款和最高可达5.25亿元的销售里程碑付款。此外,公司还将根据授权地区的产品销售额收取高个位数至双位数百分比的梯度销售分成。
《每日经济新闻》记者注意到,在2025年之前,荣昌生物仅在2021年公开宣布过一笔BD,而本次与参天中国的合作是公司今年公布的第二笔BD。
RC28-E预计今年下半年在国内递交一项上市申请
参天制药在眼科领域拥有130多年的深厚专业积累,以及覆盖60多个国家和地区的强大销售网络。其中国子公司此次从荣昌生物引进的RC28-E注射液,是一种针对眼部新生血管性疾病的VEGF(血管内皮生长因子)/FGF(成纤维细胞生长因子)双靶标融合蛋白药物。
资料显示,VEGF和FGF在激活受体后会导致新生血管生成并影响血管通透性,而RC28能竞争性抑制VEGF和FGF与它们的受体结合,从而阻止VEGF和FGF家族受体的激活、抑制内皮细胞增殖和血管新生,最终达到治疗湿性年龄相关性黄斑变性等血管新生性眼科疾病的目的。
2023年,荣昌生物先后启动了RC28-E注射液治疗湿性年龄相关性黄斑变性(wAMD)和治疗糖尿病黄斑水肿(DME)的Ⅲ期临床试验。
今年5月7日,RC28-E治疗糖尿病性黄斑水肿的Ⅱ期临床试验结果在美国眼科与视觉研究协会年会(“ARVO 2025”)上以口头报告形式公布。记者发现,6月23日,相关论文发表于《British Journal of Ophthalmology》(《英国眼科杂志》)。
根据论文,Ⅱ期临床试验共纳入156名18岁及以上、患有中心性DME、最佳矫正视力(BCVA)为73至24个ETDRS(早期糖尿病视网膜病变治疗研究,是一种标准化的视力测试方法)字母、黄斑中心区视网膜厚度(CST)≥300微米的患者。
研究显示,在提高DME患者最佳矫正视力、降低黄斑中心区视网膜厚度以及有效缓解黄斑水肿方面,RC28-E均表现出色。
公司表示,RC28-E注射液治疗DME适应证预计于2025年下半年递交中国上市申请,治疗wAMD的适应证预计于2026年年中递交中国上市申请。
国产抗VEGF眼药正处于从仿制到创新的过渡阶段
作为“ADC第一股”,荣昌生物今年宣布的两笔BD交易的标的——泰它西普和RC28均不是ADC药物,而是融合蛋白药物。其中,RC28撑起了荣昌生物的3条眼科在研管线,适应证除了上文提到的wAMD和DME,还包括糖尿病视网膜病变。
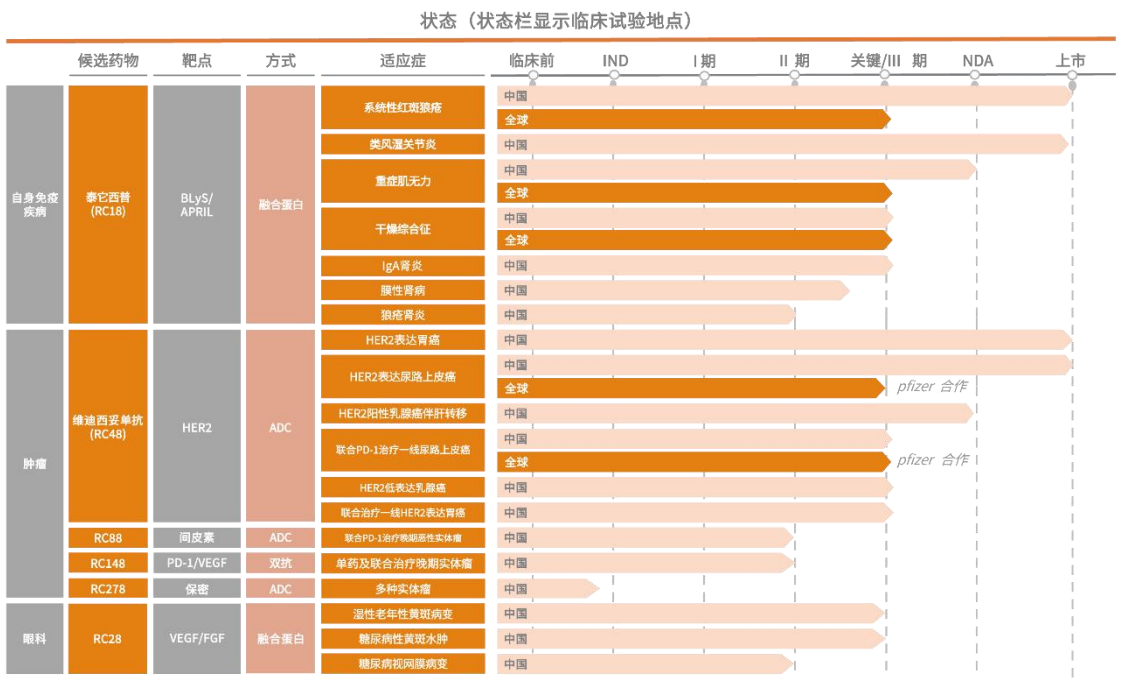
荣昌生物研发管线(截至2024年末)图片来源:公司2024年年报
记者注意到,与中国药企已经在ADC药物领域占据重要地位不同,国内眼科药物的市场起步较晚,随着再生元的阿柏西普、罗氏的雷珠单抗的专利相继到期,国内仿制药研发进入白热化阶段。
比如,齐鲁制药的雷珠单抗生物类似药QL1205于去年8月在国内获批,是国内首个获批的雷珠单抗生物类似药;阿柏西普生物类似药中,博安生物(06955.HK)的LY09004、迈威生物(688062.SH)的9MW0813均计划在今年递交上市申请。
而在眼科创新药领域,以罗氏的法瑞西单抗为代表的双靶点药物研发已成为重要研发方向之一,国产抗VEGF眼科药物正从仿制跟随走向创新竞争的新阶段。
目前,除了荣昌生物的RC28-E,国内进展较快的还包括信达生物(01801.HK)的IBI302——VEGFR-CR1双靶药依莫芙普。资料显示,该药物在传统VEGF结合域之外增加C端补体结合域,可同时抑制VEGF介导的新生血管生成和补体活化通路。
在“ARVO 2025”上,信达生物也口头报告了公司VEGFR-CR1双靶药依莫芙普(IBI302)的Ⅱ期临床数据。数据显示,高剂量依莫芙普在视力及解剖学改善中展现出积极治疗结果的同时,延长了给药间隔且兼具抗黄斑萎缩的潜力。

